添加日期:2016年9月2日 阅读:1435
今日,国家药监总局发布《关于化学药品新注册分类收费标准有关事宜的通告》(2016年第124号)。
根据《关于发布化学药品注册分类改革工作方案的公告》(国家药监总局2016年第51号公告),我国对化学药品进行了重新分类。具体类别如下:

根据《关于发布药品、医疗器械产品注册收费标准的公告》(国家药监总局2015年第53号公告),我国药品注册费标准如下:
新分类后化学药品注册收费标准等有关事宜通告如下:
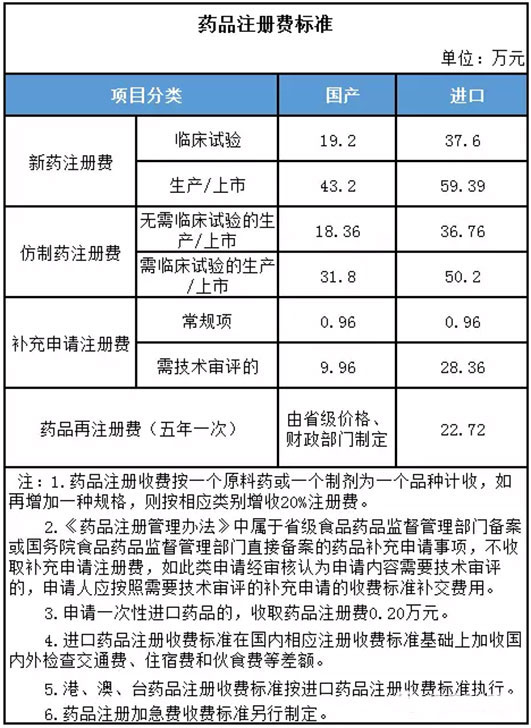
化学药品新注册分类1、2类别药品的注册申请,按照2015年第53号公告中,新药注册费标准收费;
化学药品新注册分类3、4类别药品的注册申请,按照2015年第53号公告中,仿制药注册费标准收费。
注:上述两项中,生产企业位于境内的,按照2015年第53号公告中国产注册费标准收费;生产企业位于境外的,按照2015年第53号公告中进口注册费标准收费。
化学药品新注册分类5类别药品的注册申请,按照2015年第53号公告中,进口无需临床试验的生产/上市、进口需临床试验的生产/上市注册费标准收费。
2016年第51号公告发布实施后,及本通告发布实施前,按照新注册分类受理的但《行政许可项目缴费通知书》中适用收费标准与本通告不一致的,申请人于2016年10月30日前向原受理部门申请退还或补交相关费用。申请人需提交的材料包括:
(一)退费或补交费用申请;
(二)银行汇款单据(复印件);
(三)《非税收入一般缴款书》(申请补交费用时提供复印件,申请退费时提供原件);
(四)《药品注册申请表》(复印件);
(五)《受理通知书》(复印件)。
2016年51号公告发布实施前已受理,并申请按照新注册分类进行审评审批的,申请人向原受理部门申请补交相关费用。申请人补交相关费用前,相应注册申请的审评审批工作暂停。申请人需提交的材料包括:
(一)补交费用申请;
(二)银行汇款单据(复印件);
(三)《非税收入一般缴款书》(复印件);
(四)《药品注册申请表》(复印件);
(五)《受理通知书》(复印件)。
文章来源:
1.凡本网注明“来源:1168医药招商网”的所有作品,均为广州金孚互联网科技有限公司-1168医药招商网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:1168医药招商网http://www.1168.tv”。违反上述声明者,本网将追究其相关法律责任。
2.本网转载并注明自其它来源(非1168医药招商网)的作品,目的在于传递更多信息,并不代表本网赞同其观点或和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。
3.其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
4.如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。联系邮箱:1753418380@qq.com。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。
 粤公网安备 44011102000390号
粤公网安备 44011102000390号